ИУЩЬЦЗЮЊБЃНЁЪГЦЗЃЌОпгаХњзМЮФКХЃКЙњЪГвЉМраЕ(зМ)зж2013Ек3401853КХЃЌЗћКЯЙњМвЪГЦЗвЉЦЗМрЖНЙмРэОжЖдБЃНЁЪГЦЗЕФзЂВсвЊЧѓЁЃ
- ВњЦЗУћГЦЃКвваЭИЮбзВЁЖО(HBV)КЫЫс(DNA)МьВтЪдМСКа(гЋЙтЬНеыЗЈ)
- еаЩЬЧјгђЃКШЋЙњ
- ЫљЪєРрБ№ЃКвНСЦЦїаЕ > ФкПЦ
- ВњЦЗЙцИёЃК48ШЫЗн/Ка
- ХњзМЮФКХЃКЙњЪГвЉМраЕ(зМ)зж2013Ек3401853КХ
- вНБЃРраЭЃК
- еаЩЬЦѓвЕЃКЖЋББжЦвЉМЏЭХСЩФўЩњЮявНвЉгаЯоЙЋЫО
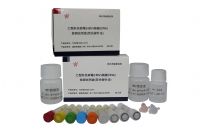
ВњЦЗадФм
• СщУєЖШ10 IU/ml • бљБОСП200 ІЬl
• ЯпадЗЖЮЇ30~3ЁС108 IU/ml • ФкБъга
• ЛљвђаЭHBV 8 ИібЧаЭ• ВйзїгХЪЦМђБуЁЂОЋШЗЁЂЮШЖЈ
ВњЦЗЙцИё
48 ШЫЗн/Ка
гУЭО
БОЪдМСКаВЩгУЪЕЪБгЋЙтЖЈСПPCR ММЪѕЃЌЖдШЫбЊЧхЛђбЊНЌбљБОжаЕФввИЮВЁЖОКЫЫс
ЃЈHBV DNAЃЉНјааЖЈСПМьВтЃЌЪЪгУгкНгЪмПЙВЁЖОжЮСЦЕФввИЮЛМепЃЌЭЈЙ§ЖдввИЮ
ЛМепбЊЧхЛђбЊНЌжаHBV DNA ЛљЯпЫЎЦНКЭХЈЖШБфЛЏЧщПіЕФМрВтЃЌгУгкЦРЙРПЙВЁЖО
жЮСЦЕФгІД№КЭжЮСЦаЇЙћЕФЦРМлЁЃ
ЁОВњЦЗУћГЦЁП
ЭЈгУУћГЦЃКвваЭИЮбзВЁЖОЃЈHBVЃЉКЫЫсЃЈDNAЃЉМьВтЪдМСКаЃЈгЋЙтЬНеыЗЈЃЉ
гЂЮФУћГЦЃКHepatitis B Virus DNA Quantitative Diagnostic Kit
ЁОАќзАЙцИёЁП
48 ШЫЗн/Ка
ЁОдЄЦкгУЭОЁП
БОЪдМСКаВЩгУЪЕЪБгЋЙтЖЈСПPCR ММЪѕЃЌЖдШЫбЊЧхЛђбЊНЌбљБОжаЕФввИЮВЁЖОКЫЫсЃЈHBV DNAЃЉНјаа
ЖЈСПМьВтЃЌЪЪгУгкНгЪмПЙВЁЖОжЮСЦЕФввИЮЛМепЃЌЭЈЙ§ЖдввИЮЛМепбЊЧхЛђбЊНЌжаHBV DNA ЛљЯпЫЎ
ЦНКЭХЈЖШБфЛЏЧщПіЕФМрВтЃЌгУгкЦРЙРПЙВЁЖОжЮСЦЕФгІД№КЭжЮСЦаЇЙћЕФЦРМлЁЃ
ЁОМьбщдРэЁП
БОЪдМСКаВЩгУДХжщЗЈЬсШЁбЊЧхЛђбЊНЌбљБОжаВЁЖОDNAЃЌTaqman ЬНеыЗЈНјааHBV-DNA ЕФЪЕЪБгЋЙт
ЖЈСПPCR МьВтЁЃЭЈЙ§МьВтФкБъРДМрВтбљБОжаЪЧЗёОпгаPCR вжжЦЮяЃЌБмУтМйвѕадЃЛЭЈЙ§дкPCR Ьх
ЯЕжаЕФUNG УИ+dUTP ДыЪЉЃЌИпаЇНЕНтПЩФмЕФЮлШОВњЮяЃЌБмУтМйбєадЃЛЭЈЙ§ДХжщЗЈЛёЕУИпДПЖШКЫ
ЫсЃЌМгДѓМьВтбљБОСПЃЌЬсИпМьВтСщУєЖШКЭОЋШЗЖШЁЃ
ЁОДЂДцЬѕМўМАгааЇЦкЁП
1. ЪдМСКаБиаыдкРфЖГЬѕМўЯТдЫЪфЁЃ
2. БЃДцЃККЫЫсЬсШЁЪдМСКадк2-8ЁцЬѕМўЯТБЃДцЃЛКЫЫсРЉдіЪдМСКааы-20ЁцвдЯТБЃДцЃЌБмУтЖрДЮ
ЗДИДЖГШкЁЃ
3. гааЇЦкЃКБОЪдМСКагааЇЦк12 ИідТЃЌЧыдкгааЇЦкФкЪЙгУЁЃ
ЁОЪЪгУвЧЦїЁП
КЫЫсРЉдівЧЃКABI7500ЁЂBio-Rad IQ5ЁЂRoche LightCycler® 480 гЋЙтPCR вЧЁЃ
КЫЫсДПЛЏвЧЃКBioTeke iAUTOMAGTM ЯЕСаздЖЏКЫЫсЬсШЁвЧЁЃ
ЁОВњЦЗадФмжИБъЁП
БОЪдМСКаПЩМьВтЙњФкHBV ГЃМћЛљвђбЧаЭЃЈBЁЂCЁЂDЃЉЃЌзюЕЭМьГіСПЮЊ10 IU/mlЃЌЖЈСПЯпадЗЖЮЇЮЊ
30-3ЁС108 IU/mlЁЃ
БОЪдМСКаМьВтжаЙњЪГЦЗвЉЦЗМьЖЈбаОПдКЕФHBV КЫЫсЖЈСПБъзМЦЗЃЌвѕЁЂбєадВЮПМЦЗЗћКЯТЪЮЊ100%ЃЌ
ЖЈСПЯпадСщУєЖШВЮПМЦЗL0ЁЋL6 ШЋВПМьВтЮЊбєадЃЌЖЈСПЗЖЮЇЗћКЯжЪСПБъзМЁЃОЋУмЖШЪдбщБэУїЃКХњ
ФкКЭХњМфжиИДадКУЃЌМьВтНсЙћCt жЕЕФБфвьЯЕЪ§ЃМ10%ЃЌХЈЖШБфвьЯЕЪ§ЃМ50%ЁЃ
БОЪдМСКаЖдШЫОоЯИАћВЁЖОЃЌE-B ВЁЖОЃЌШЫУтвпШБЯнВЁЖОЃЌБћаЭИЮбзЃЌМзаЭИЮбзЃЌУЗЖОЃЌШЫРр№х
еюВЁЖО6 аЭЃЌЕЅДП№хеюВЁЖОI аЭЃЌЕЅДП№хеюВЁЖОII аЭЃЌМзаЭСїИаВЁЖОЃЌ№юДЏБћЫсИЫОњЃЌН№ЛЦЩЋ
ЦЯЬбЧђОњЃЌАзЩЋФюжщОњБъБОЮоЗЧЬивьадРЉдіЁЃМьВтКЌгаЙ§СПбЊКьЕААзЃЌЕЈКьЫиЃЌИЪгЭШ§ѕЅЃЌEDTA
ПЙФ§МСЃЌМАУтвпЧђЕААзIgG ЕФбљБОЃЌбљБОЖдМьВтНсЙћУЛгаВњЩњИЩШХЁЃМьВтКЌгаПЙИЮбзВЁЖОвЉЮя
ХЩТоаРЃЌРУзЗђЖЈКЭЬцБШЗђЖЈЕФбљБОЃЌвЉЮяХЈЖШДяЕНбЊвЉХЈЖШЃЌбљБОЖдМьВтНсЙћУЛгаВњЩњИЩШХЁЃ
БОЪдМСКаСйДВМьВтНсЙћБэУїЃЌ дк10-3ЁС108 IU/ml ЗЖЮЇФкЃЌ БОЦЗгыУРЙњRoche ЕФCOBAS®
AmpliPrep/COBAS® TaqMan® HBV Test, v2.0 МьВтЕФЯрЙиЯЕЪ§r=0.9767ЁЃ
ЁОзЂвтЪТЯюЁП
1. БОЪдМСКаНігУгкЬхЭтМьВтЃЌЪЙгУЧАЧызаЯИдФЖСБОЫЕУїЪщЁЃ
2. ЪдбщЧАЧыЪьЯЄКЭеЦЮеашЪЙгУвЧЦїЕФВйзїЗНЗЈКЭзЂвтЪТЯюЃЌЖдУПДЮЪЕбщНјаажЪСППижЦЁЃ
3. ЪЕбщЪвЙмРэгІбЯИёАДееPCR ЛљвђРЉдіЪЕбщЪвЕФЙмРэЙцЗЖЃЌЪЕбщШЫдББиаыНјаазЈвЕХрбЕЃЛЪЕ
бщЙ§ГЬбЯИёЗжЧјНјааЃЌЫљгУЯћКФЦЗгІУ№ОњКѓвЛДЮадЪЙгУЃЌЪЕбщВйзїЕФУПИіНзЖЮЪЙгУзЈгУЕФ
вЧЦїКЭЩшБИЃЌИїЧјИїНзЖЮгУЦЗВЛФмНЛВцЪЙгУЁЃ
4. ЫљгаМьВтбљЦЗгІЪгЮЊОпгаДЋШОадЮяжЪЃЌЪЕбщЙ§ГЬжаДЉЙЄзїЗўЃЌДївЛДЮадЪжЬзВЂОГЃЬцЛЛЪж
ЬзвдМАБмУтбљЦЗМфЕФНЛВцЮлШОЃЛбљБОВйзїЁЂЗЯЦњЮяДІРэОљашЗћКЯЯрЙиЗЈЙцвЊЧѓЃЛЮРЩњВПЁЖЮЂ
ЩњЮяЩњЮявНбЇЪЕбщЪвЩњЮяАВШЋЭЈгУзМдђЁЗКЭЁЖвНСЦЗЯЮяЙмРэЬѕР§ЁЗЁЃ
5. ЫљгаЕФЪдМСдкЪЙгУЧАЃЌОљашдкЪвЮТЯТГфЗжШкЛЏЁЂЛьдШКѓЪЙгУЁЃ
6. БОВњЦЗдкжЦБИЙ§ГЬжаЫљгУЕФШЫбЊЧхЛђбЊНЌдСЯОHBsAgЁЂanti-HCV КЭanti-HIVЃЌHBV КЫЫсЃЌ
HCV КЫЫсКЭHIV КЫЫсЪдМСМьВтГЪвѕадЁЃЕЋгЩгкФПЧАЩаУЛгавЛИіШЗШЯЕФВтЪдЗНЗЈФмБЃжЄМьВт
ЮЊвѕадЕФбљБОЭъШЋВЛЛсГіЯжHBVЁЂHCVЁЂHIV КЭЦфЫќВЁЖОДЋШОЗчЯеЃЌвђДЫБОЪдМСКажаЕФЙЄзї
БъзМЦЗКЭЖдееЦЗЖМгІАДОпгаЧБдкДЋШОадЕФбљЦЗРДЖдД§ЁЃ
ЁОЩњВњЦѓвЕЁП
ЖЋББжЦвЉМЏЭХСЩФўЩњЮявНвЉгаЯоЙЋЫО
ЕижЗЃКБОЯЊОМУММЪѕПЊЗЂЧјЗувЖТЗ198 КХ
гЪеўБрТы:117004
ЕчЛАЃК024-45689366
ДЋецЃК024-45689367
ЭјжЗwww.nepharm.com.cn
ЮТмАЬсЪО
1ЁЂСЊЯЕЪБЧыЫЕУїИУаХЯЂРДзд99вНвЉеаЩЬЭјЃЌНЋЛсШУФњЛёЕУИќЖргХЛнЁЃ
2ЁЂКЯзїЫЋЗНЧыНїЩїЁЃБОЭјеОЮЊзЈвЕЕФвЉЦЗеаЩЬЦНЬЈЃЌВЛЮЊКЯзїЫЋЗНГаЕЃШЮКЮд№ШЮМАЗчЯеЃЌКЯзїЧАЧыЯШКЫЪЕВщжЄЖдЗНжЄМўМАаХЯЂецЪЕадЃЌвдШЗБЃФњЕФРћвцВЛЪмЫ№ЪЇЁЃ
3ЁЂБОЭјеОВЛЯњЪлвЉЦЗЃЌИіШЫЙКТђепЧыЕНвНдКЛђепвЉЕъзЩбЏЙКТђЁЃ

 УіЙЋЭјАВБИ 35020302001071КХ ЛЅСЊЭјвЉЦЗаХЯЂЗўЮёзЪИёжЄЪщ жЄЪщБрКХЃКЃЈУіЃЉ-ОгЊад-2014-0001
УіЙЋЭјАВБИ 35020302001071КХ ЛЅСЊЭјвЉЦЗаХЯЂЗўЮёзЪИёжЄЪщ жЄЪщБрКХЃКЃЈУіЃЉ-ОгЊад-2014-0001